-
 คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO)
คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO) -
 คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO)
คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO) -
 คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO)
คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO) -
 คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO)
คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่นสถานบริหารจัดการงานวิจัยคลินิก (ACRO)
ความรู้เกี่ยวกับการวิจัย
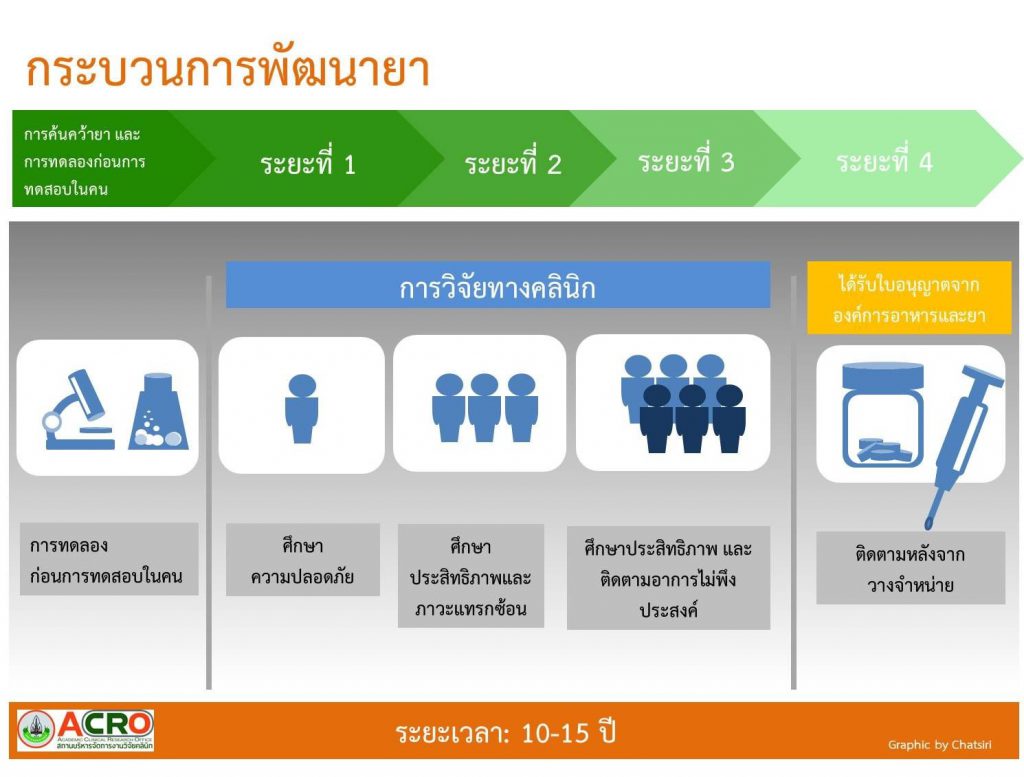
การวิจัยทางคลินิก (Clinical Trials)
การวิจัยค้นคว้าหายาใหม่ๆที่สามารถนำออกมาใช้รักษาผู้ป่วยที่เราเห็นอยู่ในปัจจุบันนั้น จำเป็นที่จะต้องผ่านขั้นตอนการวิจัย ทดสอบประสิทธิภาพ และความปลอดภัย เป็นเวลายาวนานกว่าที่จะได้ยาใหม่ขึ้นมา โดยเริ่มต้นจากสมุนไพร สารสังเคราะห์ หรือสารตั้งต้นอื่นๆ ที่มีอยู่อย่างมากมาย นำมาวิจัยเพื่อหาสารออกฤทธิ์ตามวัตถุประสงค์ของการวิจัยตัวยานั้นๆ แล้วจึงนำสารตั้งต้นที่ได้ไปทดลองคุณสมบัติทางเภสัชวิทยาต่อเซลล์ที่เพาะเลี้ยงในห้องปฏิบัติการ เมื่อพบแนวโน้มที่จะเกิดผลต่อเซลล์หรืออวัยวะที่ต้องการ จึงนำไปทดสอบต่อในสัตว์ทดลองที่มีโรคหรือพยาธิสภาพที่คล้ายคลึงกับที่เกิดในคน หลังจากได้ผลที่น่าพึงพอใจในสัตว์ทดลองแล้ว ก็ไม่ได้หมายความว่า ยาเหล่านั้นจะสามารถจำหน่ายในท้องตลาดได้ แต่ยังต้องผ่านกระบวนการศึกษาวิจัยในมนุษย์เสียก่อนว่ามีความเหมาะสม และปลอดภัยหรือไม่ ดังนั้นการพัฒนายา และวัคซีนชนิดใหม่ จึงความจำเป็นอย่างยิ่ง ที่นักวิจัยหรือบริษัทยาต้องทำการวิจัยตามรูปแบบที่ได้รับการยอมรับตามมาตรฐานสากล เพื่อรับรองความปลอดภัยและประสิทธิภาพเหมาะสมต่อการนำมาใช้ต่อไป หลักการดังกล่าวเป็นหลักการสากลที่กำหนดให้มีการวิจัยที่เป็นระบบสามารถตรวจสอบได้ และมีการรายงานผลต่อบุคคลที่เกี่ยวข้อง ทั้งผลดี และภาวะแทรกซ้อนที่เกิดขึ้นทั้งหมด โดยแบบขั้นตอนเป็น 4 ระยะ (Phase) ดังต่อไปนี้
ระยะที่ 1 ศึกษาความปลอดภัย (Phase I : Safety and dosage)
หลังจากมีการทดลองในห้องปฏิบัติการ และค้นคว้าวิจัยในสัตว์ทดลอง การศึกษาความปลอดภัยในระยะที่ 1 ถือได้ว่าเป็นขั้นตอนเริ่มต้นของการพัฒนายา และวัคซีนที่มีการศึกษาในมนุษย์ โดยจะให้ยาแก่อาสาสมัครสุขภาพดี จำนวน 20 ถึง 100 คน และจำเป็นที่จะต้องติดตามอาสาสมัครอย่างใกล้ชิด เพื่อศึกษา การดูดซึม การออกฤทธิ์ การกระยาตัวของยาที่จำเพาะต่อร่างกายมนุษย์ ซึ่งมีความแตกต่างจากสัตว์ทดลอง ปริมาณยาน้อยที่สุดที่ใช้ในการรักษาและขนาดยาที่สูงที่สุดที่สามารถนำมาใช้ได้โดยไม่มีภาวะข้างเคียง รวมทั้งภาวะข้างเคียงต่างที่เกิดขึ้นจากการใช้ยาในขนาดที่แตกต่างกัน ดังนั้นจากระยะนี้จะเป็นได้ว่าความปลอดภัยในการพัฒนายาเป็นสิ่งที่มีความจำเป็นอย่างยิ่ง โดยจะใช้เวลาประมาณ 2 เดือนในการทดสอบต่าง ๆ สุดท้ายจะมียาเพียงร้อยละ 70 เท่านั้นที่สามารถผ่านการวิจัยระยะนี้ไปได้
ระยะที่ 2 ศึกษาประสิทธิภาพ และภาวะแทรกซ้อน (Phase II : Efficacy and side effects)
ยาที่ผ่านระยะที่ 1 ได้แล้วจะได้รับการศึกษาถึงประสิทธิภาพของยา และภาวะแทรกซ้อนในระยะสั้นที่อาจเกิดขึ้นได้ของยาในกลุ่มผู้ป่วยที่เป็นโรค เพื่อหาขนาดยาที่เหมาะสมต่อการรักษาในโรคนั้นๆ ในระยะนี้จะใช้เวลาตั้งแต่เดือนจนถึง 2 ปี และต้องมีผู้ป่วยที่มากเพียงพอต่อการศึกษา ซึ่งบางครั้งอาจต้องมีอาสาสมัครถึงหลายร้อยคน เพื่อที่จะได้ผลลัพธ์ของยาที่เหมาะสมต่อการรักษาโรค เมื่อสิ้นสุดการศึกษาจะมียาเพียงประมาณร้อยละ 33 ที่จะสามารถพัฒนาต่อไปได้
ระยะที่ 3 ศึกษาประสิทธิภาพ และติดตามอาการไม่พึงประสงค์ (Phase III : Efficacy and monitoring of adverse reaction)
การศึกษาในระยะนี้จะทำในกลุ่มผู้ป่วยในโรคที่สนใจมากขึ้นกว่าระยะที่ 2 มักต้องใช้อาสาสมัครในการวิจัยตั้งแต่ 300 ถึง 3000 คน และต้องใช้เวลาหลายปีในการศึกษาในระยะนี้ โดยเฉลี่ยประมาณ 1 – 4 ปี บางครั้งการศึกษาในระยะนี้อาจเป็นการวิจัยขนาดใหญ่ที่ให้อาสาสมัครจำนวนมากในหลายๆประเทศทั่วโลก รวมทั้งการเปรียบเทียบกับยาหลอก หรือยามาตรฐานที่ใช้อยู่ในปัจจุบัน และการทดสอบปฏิกริยาของยาเมื่อใช้ร่วมกันกับยาชนิดอื่น เพื่อให้ได้ทราบถึงประโยชน์ทางการรักษาที่แท้จริงของยา และอาการไม่พึงประสงค์ที่อาจเกิดขึ้นได้ในระยะยาว บางครั้งอาการไม่พึงประสงค์ดังกล่าวเกิดได้น้อยมาก แต่มีความรุนแรงถึงชีวิต การที่มีอาสาสมัครไม่เพียงพอ และใช้ระยะเวลาศึกษาสั้นเกินไปทำให้ไม่ทราบถึงผลที่ตามมาได้อย่างครบถ้วน จากการศึกษาพบว่าเมื่อสิ้นสุดระยะนี้จะมียาเพียงร้อยละ 25-30 ที่จะนำไปขึ้นทะเบียนยาเพื่อวางจำหน่ายในท้องตลาดต่อไป
ระยะที่ 4 ติดตามหลังจากวางจำหน่าย (Phase IV : Post-marketing surveillance)
ยาที่ผ่านการศึกษาในระยะที่ 3 จะสามารถวางจำหน่ายได้ในท้องตลาด แต่อย่างไรก็การศึกษาผลการรักษา และอาการไม่พึงประสงค์ยังคงทำต้องเนื่อง โดยจะมีการติดตามผลที่ได้จากการใช้ยาในท้องตลาดว่ามีอันตรายในการใช้ยาในระยะยาวหรือไม่ บางครั้งผลกระทบที่เกิดขึ้นอาจใช้เวลาหลายปีจึงจะปรากฎให้เห็น หากมีภาวะแทรกซ้อนที่รุนแรง ยาเหล่านั้นก็อาจถูกถอนออกจากทะเบียนยาและห้ามใช้ต่อไปได้
แหล่งอ้างอิง
- The US Food and Drug Administration. Clinical Research Phase Studies in The Drug development Process [Internet]. 2018[cited 2018 Feb19]. Available from: https://www.fda.gov/ForPatients/Approvals/Drugs/ucmhtm#Clinical_Research_Phase_Studies
- Rousseaux CG, Bracken WM. Overview of Drug Development [Internet]. Third Edition. Haschek and Rousseaux’s Handbook of Toxicologic Pathology. Elsevier; 666-668. Available from: http://dx.doi.org/10.1016/B978-0-12-415759-0.00021-2
- Mwidau J, Chang D. Clinical Trials: Why Participate? [Internet]. Early Diagnosis and Treatment of Cancer Series: Colorectal Cancer. Elsevier Inc.; 2011. 219-221. Available from: http://dx.doi.org/10.1016/B978-1-4160-4686-8.50023-3
